🔹 학습 목표
- 화학 반응에서 변하지 않는 규칙이 있다는 사실을 안다.
- 질량 보존의 법칙, 일정 성분비의 법칙, 기체 반응의 법칙을 각각 이해하고 구분할 수 있다.
- 세 가지 법칙을 비교하고, 일상 속에서 적용 사례를 찾을 수 있다.
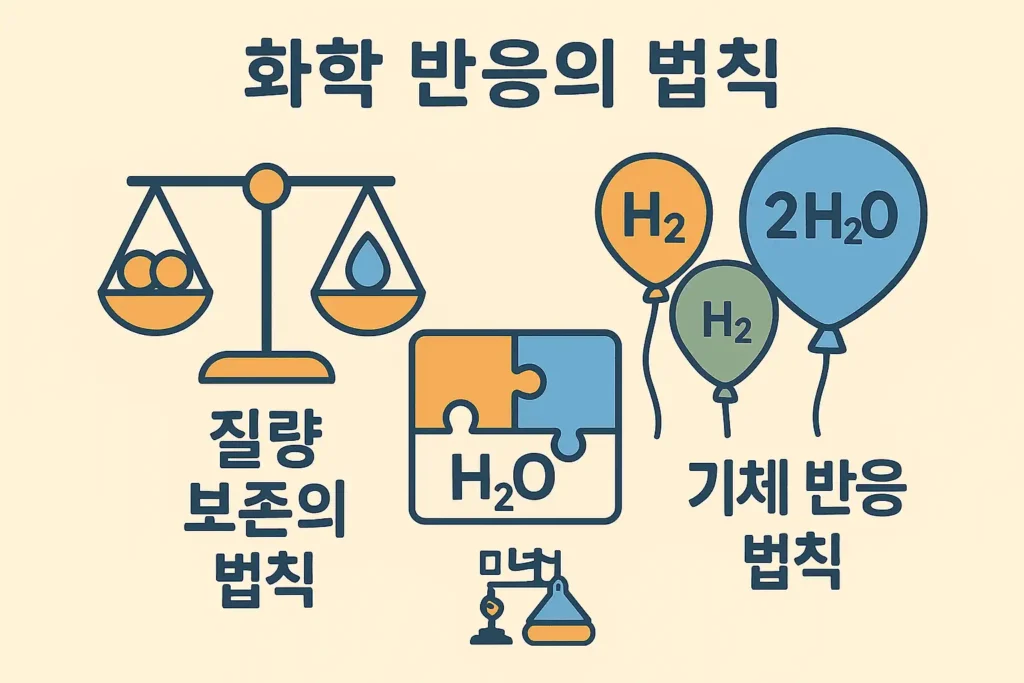
📂 개념 한눈에 보기
| 법칙 이름 | 핵심 정의 | 조건 | 주장자 |
|---|---|---|---|
| 질량 보존의 법칙 | 화학 반응 전과 후의 전체 질량은 변하지 않는다 | 모든 상태 (기체·액체·고체 포함) | 라부아지에 |
| 일정 성분비의 법칙 | 같은 화합물은 항상 같은 원소 비율로 이루어진다 | 화합물 생성 시 | 프루스트 |
| 기체 반응의 법칙 | 반응하는 기체의 부피는 항상 간단한 정수비를 이룬다 | 같은 온도와 압력 | 게이뤼삭 |
✔ 각 법칙 설명
📗 질량 보존의 법칙
- 화학 반응이 일어나도 원자는 없어지지 않고 재배열될 뿐.
- ➤ 따라서 전체 질량은 항상 같다!
- ➤ 예: 수소 2g + 산소 16g → 물 18g
📘 일정 성분비의 법칙
- 어떤 화합물이라도, 언제 어디서 만들든 항상 같은 원소 비율을 가짐.
- ➤ 예: 물은 언제나 수소 2g : 산소 16g = 1:8
- ➤ 화합물의 ‘정체성’을 지키는 규칙!
📙 기체 반응의 법칙
- 기체들끼리 반응할 때, 부피끼리의 비율이 항상 정수비로 일정함.
- ➤ 예: 수소 2L + 산소 1L → 수증기 2L (2:1:2)
- ➤ 단, 같은 온도와 압력 조건에서만 성립함.
🔹 3대 법칙 비교 정리표
| 구분 | 질량 보존의 법칙 | 일정 성분비의 법칙 | 기체 반응의 법칙 |
|---|---|---|---|
| 핵심 개념 | 전체 질량은 일정함 | 구성 비율은 항상 일정함 | 부피 비율은 정수비 |
| 상태 조건 | 모든 물질 상태 | 화합물만 해당 | 기체 상태, 같은 온도·압력 |
| 대표 키워드 | 질량 = 질량 | 고정 비율, 화합물 | 부피비, 정수비 |
| 대표 사례 | 2g H₂ + 16g O₂ = 18g H₂O | H₂O의 수소:산소 = 1:8 | 2L H₂ + 1L O₂ → 2L H₂O |
🔬 실험 활동 제안
- 베이킹소다 + 식초 반응 후, 병과 풍선 포함 전체 질량 측정 → 질량 보존 확인
- 증류수와 바닷물의 수소·산소 비율 비교 → 일정 성분비 확인
- 수소와 산소의 기체 반응 실험 (2:1로 주입하여 점화) → 기체 반응 법칙 확인
🔹 확인 퀴즈 (4문제)
- 질량 보존의 법칙에 대한 설명으로 옳은 것은?
① 화학반응 후 질량이 늘어난다 ② 질량이 줄어든다 ③ 질량이 변하지 않는다 ④ 질량은 예측 불가능하다 - 일정 성분비의 법칙을 설명하는 것은?
① 같은 화합물이라도 성분이 달라질 수 있다 ② 비율은 실험마다 다르다
③ 화합물은 일정한 비율로 구성된다 ④ 원소는 자유롭게 결합한다 - 기체 반응의 법칙에 대한 설명 중 옳은 것은?
① 기체 반응에는 부피 개념이 없다
② 기체 반응은 질량만 본다
③ 기체는 일정한 정수비로 반응한다
④ 온도와 압력에 관계없이 성립한다 - 다음 중 3대 화학 법칙 모두와 관련 있는 공통 개념은?
① 전기 ② 분자 구조 ③ 원자 보존 ④ 색 변화
✅ 정답 및 해설
- ③ 질량 보존의 법칙은 반응 전후의 전체 질량이 같다는 원리
- ③ 화합물은 항상 일정한 원소 비율로 구성됨
- ③ 기체는 같은 온도·압력 조건에서 정수비로 부피가 반응함
- ③ 모든 법칙은 “원자는 사라지거나 생기지 않고 재배열만 된다”는 공통 개념을 가짐
💬 감성 마무리
화학의 세계는 마법처럼 보이지만, 그 안에는 질서와 수학적인 아름다움이 숨겨져 있습니다. 과학은 변화 속에서 규칙을 찾아내는 언어입니다. ⚖️
© 저작권 안내
본 자료는 창작 교육 콘텐츠입니다. 출처를 밝힌 비상업적 공유는 가능하나, 무단 복제나 상업적 이용은 금지됩니다.